Nitrat de calci
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 163,938 Da |
| Estructura química | |
| Fórmula química | CaN₂O₆ |
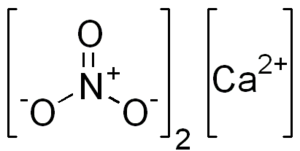 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El nitrat de calci (antigament conegut com a nitrat de Noruega) és un compost químic inorgànic amb la fórmula Ca(NO₃)₂. És una sal incolora que absorbeix la humitat de l'aire i habitualment es troba sota la forma de cristal·lització tetrahidratada. Principalment es fa servir com fertilitzant, especialment en la fertirrigació, però també té altres aplicacions. En forma de mineral hidratat rep el nom de nitrocalcita i es forma per eflorescència en ambients secs o en cavernes. Se'n coneixen moltes sals relacionades.[1]
Producció
[modifica]El nitrat de calci va ser el primer fertilitzant de nitrogen que es va poder sintetitzar i fabricar. La seva producció va començar a Notodden, Noruega l'any 1905 mitjançant el procés Birkeland–Eyde. Actualment la majoria del nitrat de calci mundial es fa a Porsgrunn.
Es produeix mitjançant el tractament d'àcid nítric, segit per la neutralització amb amoníac:
- CaCO₃ + 2 HNO₃ → Ca(NO₃)₂ + CO₂ + H₂O
També es pot produir per una solució aquosa de nitrat d'amoni i hidròxid de calci:
- 2 NH₄NO₃ + Ca(OH)₂ → Ca(NO₃)₂ + 2 NH₄OH
Es descompon per la calor alliberant diòxid de nitrogen:[1]
- 2 Ca(NO₃)₂ → 2 CaO + 4 NO₂ + O₂ ΔH = 369 kJ/mol
Aplicacions
[modifica]Com fertilitzant
[modifica]L'any 1978, només es van produir 170.000 tones per a usar com fertilitzant.[1] El seu ús ha anat en augment i es fa servir en hivernacles, hidroponia i fertirrigació on l'adob comercial on sovint conté també nitrat d'amoni i la "doble sal" 5Ca(NO₃)₂.NH₄NO₃.10H₂O. També existeix una formulació líquida (9-0-0 + 11% Ca)
Pel tractament d'aigües residuals
[modifica]Es fa servir el nitrat de calci per eliminar la pudor, aturant la metabolització dels sulfats, durant el tractament de les aigües residuals.[2]
Ciment
[modifica]És un additiu del ciment per accelerar o facilitar el seu enduriment.[3] L'anió nitrat comporta la formació de l'hidròxid de ferro, que forma una capa de passivació que redueix la corrosió del formigó armat.[4]
Produir refredament
[modifica]La dissolució de nitrat de calci és molt endotèrmica i per tant té un efecte refredant.[1]
Produir calor
[modifica]El nitrat de calci junt amb els nitrats de sodi i potassi es fa servir per emmagatzemar energia en les plantes d'energia solar.
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 Wolfgang Laue, Michael Thiemann, Erich Scheibler, Karl Wilhelm Wiegand “Nitrates and Nitrites” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.doi:10.1002/14356007.a17_265. Article Online Posting Date: June 15, 2000
- ↑ Bentzen, G.; Smith, A.T.; Bennett D.; Webster, N. J., Reinholt F.; Sletholt, E.; Hobson, J. (1995) "Controlled dosing of nitrate for prevention of H2S in a sewer network and the effects on the subsequent treatment process" Water Sci. Tech. Vol 31, No 7, pp. 293-302, 1995.
- ↑ Justines, H. (2010) "Calcium Nitrate as a Multifunctional Concrete Admixture" Concrete Magazine, Vol 44, No1, p.34. ISSN 0010-5317
- ↑ Al-Amoudi, O. S.; Maselehuddin, M.; Lashari, A.N.; Almussalem, A.A. "Effectiveness of corrosion inhibitors in contaminated concrete" Cement & Concrete Composites, 2003 volume 25, pp. 439-449.
